■ Sel Kimia
| ► | Suatu sel elektrokimia yang menghasilkan tenaga elektrik daripada tindak balas yang berlaku di dalam sel. |
| ► | Terdiri daripada dua elektrod logam yang berbeza. | ||||||||||
| ► | Disambungkan dengan hujung wayar dan hujung yang satu lagi dicelup ke dalam larutan elektrolit. | ||||||||||
| ► | Beza keupayaan yang terhasil bergantung kepada perbezaan kedudukan logam yang digunakan dalam siri elektrokimia.
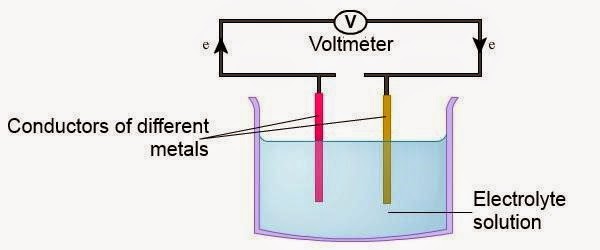 |
||||||||||
| ► |
Arus elektrik mengalir ke arah yang bertentangan dengan aliran elektron. |
| ► | Zink terletak lebih tinggi dalam siri elektrokimia (lebih elektropositif) akan bertindak sebagai terminal negatif. | |||||||||||||
| Kuprum terletak lebih rendah dalam siri elektrokimia (kurang elektropositif) akan bertindak sebagai terminal positif. | ||||||||||||||
 |
||||||||||||||
| ► |
Arus elektrik mengalir ke arah yang bertentangan dengan aliran elektron. Persamaan ion keseluruhan : Zn + CU2+ → Zn2+ + Cu |
■ Sel Daniel
| ► | Terdiri daripada dua elektrod logam yang berbeza yang direndam dalam dua larutan elektrolit yang berasingan. | ||||||||||
| ► | Larutan elektrolit dipisahkan sama ada dengan pasu berliang atau jambatan garam. | ||||||||||
| ► | Fungsi pasu berliang atau jambatan garam: untuk memisahkan dua larutan elektrolit tetapi membenarkan ion melaluinya untuk melengkapkan litar. | ||||||||||
| ► | Tenaga kimia → Tenaga elektrik
Arus elektrik mengalir ke arah yang bertentangan dengan aliran elektron. |
Larutan elektrolit dipisahkan oleh jambatan garam. |
|||||||||
Larutan elektrolit dipisahkan oleh pasu berliang.
 |
|||||||||
Larutan elektrolit dipisahkan oleh jambatan garam (tiub-U).
 |
|||||||||
Tindak balas kimia:
Arus elektrik mengalir ke arah yang bertentangan dengan aliran elektron. Persamaan ion keseluruhan: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) |
■ Sel kimia boleh dibahagikan kepada dua jenis:
| ► | Sel-sel primer: sel-sel tidak boleh dicas semula | |
| ► | Sel sekunder: sel-sel boleh dicas semula |
 |
► | Terminal positif : rod karbon 2MnO2(p) + 2NH4+(ak) + 2e- → Mn2O3(p) + 2NH3(g) + H2O(ce) |
| ► | Terminal negatif : zink Zn(s) → Zn2+(ak) + 2e- |
|
| ► | Elektrolit: Campuran ammonium klorida dan zink klorida. | |
| ► | Kelebihan: ringan dan bekalan arus yang stabil. | |
| ► | Kelemahan: tidak tahan lama dan tidak boleh dicas semula. | |
 |
► | Terminal positif: Manganese(IV) oksida 2MnO2(p) + H2O(ce) + 2e- → Mn2O3(p) + OH-(ak) |
| ► | Terminal negatif: Zink Zn(s) → Zn2+(aq) + 2e- |
|
| ► | Elektrolit: Campuran ammonium klorida dan zink klorida. | |
| ► | Kelebihan: tahan lama dan bekalan voltan yang lebih tinggi daripada sel kering. | |
| ► | Kelemahan: lebih mahal daripada sel kering dan tidak boleh dicas semula. | |
 |
► | Terminal positif: Mercuri(II) oksida HgO(p) + H2O(ce) + 2e- → Hg(ce) + 2OH-(ak) |
| ► | Terminal negatif: Zink Zn(s) → Zn2+(aq) + 2e- |
|
| ► | Elektrolit: Campuran zink hidroksida dan larutan kalium hidroksida. | |
| ► | Kelebihan: tahan lama dan dan bekalan arus yang stabil. | |
| ► | Kelemahan: tidak boleh dicas semula. |
 |
► | Terminal positif: Plumbum(IV) oksida PbO2(p) + 4H+(ak) + 2e- → Pb2+(ak) + 2H2O(ce) |
| ► | Terminal negatif: Plumbum Pb(s) → Pb2+(ak) + 2e- |
|
| ► | Elektrolit: asid sulfurik cair. | |
| ► | Kelebihan: boleh dicas semula dan bekalan voltan tinggi untuk jangka masa yang panjang. | |
| ► | Kelemahan: berat, mahal dan penggunaan elektrolit yang mengkakis | |
 |
► | Terminal positif: Nikel(IV) oksida NiO2(p) + 2H2O(ce) + 2e- → Ni(OH)2(p) + 2OH- |
| ► | Terminal negatif: kadmium Cd(s) + 2OH- → Cd(OH)2(s) + 2e- |
|
| ► | Elektrolit: Kalium hidroksida. | |
| ► | Kelebihan: tahan lama, boleh dicas semula dan kepekatan elektrolit tidak berubah. | |
| ► | Kelemahan: mahal |
■ Persamaan sel elektrolisis dan sel kimia.
| ► | Terdiri daripada anod dan katod yang [terminal positif dan terminal negatif] | |
| ► | Mengandungi elektrolit | |
| ► | Tindak balas kimia melibatkan menderma atau menerima elektron | |
| ► | Ion positif dan negatif bergerak ke elektrod dalam elektrolit | |
| ► | Elektron bergerak dari anod ke katod [terminal negatif ke terminal positif dalam litar luar] |
| Perbezaan | Sel elektrolitik | Sel kimia |
| Struktur sel |  |
 |
| Diperbuat daripada | Karbon atau logam yang berbeza/ sama yang direndamkan dalam elektrolit | Dua logam berbeza yang direndamkan dalam elektrolit |
| Arus elektrik | Menghasilkan tindak balas kimia | Dihasilkan oleh tindak balas kimia |
| Perubahan tenaga | Tenaga elektrik kepada tenaga kimia | Tenaga kimia kepada tenaga elektrik |
| Katod | Kation menerima elektron | Elektron diterima |
| Anod | Anion melepaskan elektron | Elektron dilepaskan |
| Penggunaan bateri | Menggunakan bateri | Tidak menggunakan bateri |
| ⇲ Dapatkan latihan (objektif and subjektif), secara percuma untuk OS Android. | ||
 |
 |
|


thank you for sharing! complete note for my lesson. I luv it.
ReplyDeleteTerima kasih atas nota dan maklumat oenting yg diberi ia sgt membantu
ReplyDeleteI think it's very suitable for me because it helps me to study easily... thank youu
ReplyDeleteYou are the best
Tq so muchhh....so useful and understanable..👍👍👍👍i needed this😢😢😢😢
ReplyDeletethank you for this meaningful informatioon
ReplyDelete