Showing posts with label Kimia_T4_B6. Show all posts
Showing posts with label Kimia_T4_B6. Show all posts
Wednesday, 27 May 2015
Sunday, 1 March 2015
Makmal Aktiviti 6.6.2: Untuk membina siri elektrokimia berdasarkan penyesaran logam
 |
Makmal Aktiviti 6.6.2: Untuk membina siri elektrokimia berdasarkan penyesaran logam |
Problem statement: Bagaimanakah siri elektrokimia dibina daripada tindak balas penyesaran logam daripada larutan garam dengan logam lain?
Hipotesis: Siri elektrokimia boleh dibina daripada prinsip bahawa logam terletak lebih tinggi dalam siri elektrokimia boleh menggantikan logam lain yang terletak lebih rendah dalam siri elektrokimia dari larutan garam.
Pembolehubah:
| » | Pembolehubah dimalarkan: Kepekatan elektrolit | |
| » | Pembolehubah dimanipulasikan: logam yang berbeza | |
| » | Pembolehubah bergerakbalas: Perubahan warna larutan terbentuk |
|
Bahan: » Zink klorida » Besi (III) nitrate » Kuprum (II) sulfat » Plumbum (II) nitrat » Magnesium klorida » Kepingan Zink » Paku besi » Kepingan kuprum » Jalur plumbum » Jalur Magnesium |
Radas: » Tabung uji » Kertas Pasir |
| ► |
|
| ► | Animasi berikut menunjukkan prosedur dan pemerhatian eksperimen. |
|||||||||||||||||||||||||||||||||||||
| ► |
✘ - tindak balas penyesaran tidak berlaku |
| ► | Kuprum adalah paling kurang elektropositif daripada 5 logam kerana ia tidak boleh menggantikan mana-mana logam lain daripada larutan garam mereka. | |
| ► | Magnesium adalah yang paling elektropositif daripada 5 logam kerana ia menyesarkan semua logam lain daripada larutan garam mereka. | |
| ► | Berdasarkan keputusan eksperimen, siri elektrokimia boleh dibina dengan menyusun logam yang lebih elektropositif dahulu: |
| ► | Logam yang lebih elektropositif akan menyesarkan logam yang kurang elektropositif daripada larutan garamnya. | |
| ► | Hipotesis diterima. |
| ⇲ Dapatkan latihan (objektif and subjektif), secara percuma untuk OS Android. | ||
 |
 |
|
Makmal Aktiviti 6.6.1: Membina siri elektrokimia berdasarkan beza keupayaan antara dua logam
 |
Makmal Aktiviti 6.6.1: Membina siri elektrokimia berdasarkan beza keupayaan antara dua logam |
Pernyataan masalah: Bagaimanakah siri elektrokimia dibina daripada perbezaan keupayaan antara dua logam dalam sel ringkas?
Hipotesis: Siri elektrokimia boleh dibina dengan mengukur perbezaan keupayaan antara dua logam dalam sel ringkas.
Pembolehubah:
| » | Pembolehubah dimalarkan: Kepekatan elektrolit | |
| » | Pembolehubah dimanipulasikan: Pasangan Logam | |
| » | Pembolehubah bergerakbalas: Voltan cell |
|
Bahan: » Kepingan Zink »Iron kuku » Kepingan Aluminium » Jalur Magnesium » Kepingan kuprum » Jalur argentum » Larutan kuprum(II) sulfat 1 mol dm-3 |
Apparatus: » Bikar » Voltmeter » Kertas Pasir » Klip Buaya » Sambungan wayar |
| ► | 
|
| Pasangan logam | Terminal positif | Terminal negatif | Voltan |
| Fe/Cu | Kuprum | Besi | 0.7 |
| Mg/Cu | Kuprum | Magnesium | 2.7 |
| Al/Cu | Kuprum | Aluminium | 2.0 |
| Zn/Cu | Kuprum | Zink | 1.1 |
| Ag/Cu | Argentum |
Kuprum
|
1.1 |
| ► | Mg, Fe, Zn dan Al lebih reaktif daripada kuprum kerana mereka membentuk terminal negatif manakala kuprum membentuk terminal positif. | |
| ► | Cu adalah lebih reaktif daripada argentum kerana ia membentuk terminal negatif manakala argentum membentuk terminal positif. | |
| ► | Berdasarkan keputusan eksperimen, sebahagian daripada siri elektrokimia boleh dibina seperti yang ditunjukkan di bawah. |
► Pasangan logam yang lebih jauh dalam siri elektrokimia menghasilkan voltan yang lebih tinggi daripada pasangan logam yang rapat antara satu sama lain.
Kesimpulan:
| ► | Siri elektrokimia boleh dibina dengan menggunakan pasangan logam yang berbeza dalam sel kimia ringkas. | |
| ► | Hipotesis diterima. |
| ⇲ Dapatkan latihan (objektif and subjektif), secara percuma untuk OS Android. | ||
 |
 |
|
6.6 Siri Elektrokimia
Siri Elektrokimia
■ Siri Elektrokimia
■ Siri elektrokimia boleh dibina berdasarkan:
■ Video berikut mengandungi maklumat tentang siri elektrokimia.
■ Siri Elektrokimia
| ► | Satu siri susunan unsur mengikut tertib berdasarkan kecenderungan untuk melepaskan elektron. 
|
|||||||
| ► | Unsur yang terletak di kedudukan yang lebih tinggi dalam siri elektrokimia:
|
| ► | Beza keupayaan antara dua logam dalam sel kimia.
|
|||||||||||||
| ► | Sesaran logam oleh logam yang lebih reaktif daripada larutan garam.
|
| ⇲ Dapatkan latihan (objektif and subjektif), secara percuma untuk OS Android. | ||
 |
 |
|
6.5 Sel Kimia
Sel Kimia
■ Sel Kimia
■ Sel ringkas
■ Sel ringkas: kepingan zink dan kepingan kuprum direndamkan ke dalam larutan kuprum (II) sulfat.
■ Video berikut menunjukkan aliran ion dalam sel ringkas.
Sel Daniel
■ Sel Daniel
■ Video berikut menunjukkan aliran ion dalam sel Daniel.
■ Susunan sel Daniel.
Sel kimia lain
■ Sel kimia boleh dibahagikan kepada dua jenis:
■ Primary cell:
■ Secondary cell:
■ Video berikut menunjukkan fungsi dan cara kerja bateri di dalam kereta.
Persamaan dan perbezaan sel elektrolisis dan sel kimia
■ Persamaan sel elektrolisis dan sel kimia.
■ Sel elektrolitik berbeza dari sel kimia dalam beberapa aspek
■ Sel Kimia
| ► | Suatu sel elektrokimia yang menghasilkan tenaga elektrik daripada tindak balas yang berlaku di dalam sel. |
| ► | Terdiri daripada dua elektrod logam yang berbeza. | ||||||||||
| ► | Disambungkan dengan hujung wayar dan hujung yang satu lagi dicelup ke dalam larutan elektrolit. | ||||||||||
| ► | Beza keupayaan yang terhasil bergantung kepada perbezaan kedudukan logam yang digunakan dalam siri elektrokimia.
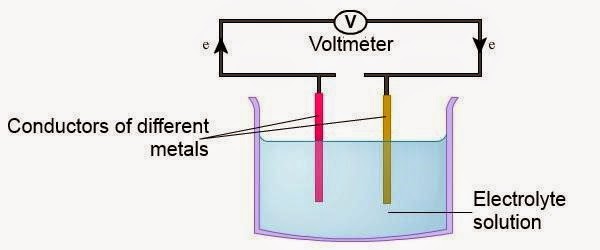 |
||||||||||
| ► |
Arus elektrik mengalir ke arah yang bertentangan dengan aliran elektron. |
| ► | Zink terletak lebih tinggi dalam siri elektrokimia (lebih elektropositif) akan bertindak sebagai terminal negatif. | |||||||||||||
| Kuprum terletak lebih rendah dalam siri elektrokimia (kurang elektropositif) akan bertindak sebagai terminal positif. | ||||||||||||||
 |
||||||||||||||
| ► |
Arus elektrik mengalir ke arah yang bertentangan dengan aliran elektron. Persamaan ion keseluruhan : Zn + CU2+ → Zn2+ + Cu |
■ Sel Daniel
| ► | Terdiri daripada dua elektrod logam yang berbeza yang direndam dalam dua larutan elektrolit yang berasingan. | ||||||||||
| ► | Larutan elektrolit dipisahkan sama ada dengan pasu berliang atau jambatan garam. | ||||||||||
| ► | Fungsi pasu berliang atau jambatan garam: untuk memisahkan dua larutan elektrolit tetapi membenarkan ion melaluinya untuk melengkapkan litar. | ||||||||||
| ► | Tenaga kimia → Tenaga elektrik
Arus elektrik mengalir ke arah yang bertentangan dengan aliran elektron. |
Larutan elektrolit dipisahkan oleh jambatan garam. |
|||||||||
Larutan elektrolit dipisahkan oleh pasu berliang.
 |
|||||||||
Larutan elektrolit dipisahkan oleh jambatan garam (tiub-U).
 |
|||||||||
Tindak balas kimia:
Arus elektrik mengalir ke arah yang bertentangan dengan aliran elektron. Persamaan ion keseluruhan: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) |
■ Sel kimia boleh dibahagikan kepada dua jenis:
| ► | Sel-sel primer: sel-sel tidak boleh dicas semula | |
| ► | Sel sekunder: sel-sel boleh dicas semula |
 |
► | Terminal positif : rod karbon 2MnO2(p) + 2NH4+(ak) + 2e- → Mn2O3(p) + 2NH3(g) + H2O(ce) |
| ► | Terminal negatif : zink Zn(s) → Zn2+(ak) + 2e- |
|
| ► | Elektrolit: Campuran ammonium klorida dan zink klorida. | |
| ► | Kelebihan: ringan dan bekalan arus yang stabil. | |
| ► | Kelemahan: tidak tahan lama dan tidak boleh dicas semula. | |
 |
► | Terminal positif: Manganese(IV) oksida 2MnO2(p) + H2O(ce) + 2e- → Mn2O3(p) + OH-(ak) |
| ► | Terminal negatif: Zink Zn(s) → Zn2+(aq) + 2e- |
|
| ► | Elektrolit: Campuran ammonium klorida dan zink klorida. | |
| ► | Kelebihan: tahan lama dan bekalan voltan yang lebih tinggi daripada sel kering. | |
| ► | Kelemahan: lebih mahal daripada sel kering dan tidak boleh dicas semula. | |
 |
► | Terminal positif: Mercuri(II) oksida HgO(p) + H2O(ce) + 2e- → Hg(ce) + 2OH-(ak) |
| ► | Terminal negatif: Zink Zn(s) → Zn2+(aq) + 2e- |
|
| ► | Elektrolit: Campuran zink hidroksida dan larutan kalium hidroksida. | |
| ► | Kelebihan: tahan lama dan dan bekalan arus yang stabil. | |
| ► | Kelemahan: tidak boleh dicas semula. |
 |
► | Terminal positif: Plumbum(IV) oksida PbO2(p) + 4H+(ak) + 2e- → Pb2+(ak) + 2H2O(ce) |
| ► | Terminal negatif: Plumbum Pb(s) → Pb2+(ak) + 2e- |
|
| ► | Elektrolit: asid sulfurik cair. | |
| ► | Kelebihan: boleh dicas semula dan bekalan voltan tinggi untuk jangka masa yang panjang. | |
| ► | Kelemahan: berat, mahal dan penggunaan elektrolit yang mengkakis | |
 |
► | Terminal positif: Nikel(IV) oksida NiO2(p) + 2H2O(ce) + 2e- → Ni(OH)2(p) + 2OH- |
| ► | Terminal negatif: kadmium Cd(s) + 2OH- → Cd(OH)2(s) + 2e- |
|
| ► | Elektrolit: Kalium hidroksida. | |
| ► | Kelebihan: tahan lama, boleh dicas semula dan kepekatan elektrolit tidak berubah. | |
| ► | Kelemahan: mahal |
■ Persamaan sel elektrolisis dan sel kimia.
| ► | Terdiri daripada anod dan katod yang [terminal positif dan terminal negatif] | |
| ► | Mengandungi elektrolit | |
| ► | Tindak balas kimia melibatkan menderma atau menerima elektron | |
| ► | Ion positif dan negatif bergerak ke elektrod dalam elektrolit | |
| ► | Elektron bergerak dari anod ke katod [terminal negatif ke terminal positif dalam litar luar] |
| Perbezaan | Sel elektrolitik | Sel kimia |
| Struktur sel |  |
 |
| Diperbuat daripada | Karbon atau logam yang berbeza/ sama yang direndamkan dalam elektrolit | Dua logam berbeza yang direndamkan dalam elektrolit |
| Arus elektrik | Menghasilkan tindak balas kimia | Dihasilkan oleh tindak balas kimia |
| Perubahan tenaga | Tenaga elektrik kepada tenaga kimia | Tenaga kimia kepada tenaga elektrik |
| Katod | Kation menerima elektron | Elektron diterima |
| Anod | Anion melepaskan elektron | Elektron dilepaskan |
| Penggunaan bateri | Menggunakan bateri | Tidak menggunakan bateri |
| ⇲ Dapatkan latihan (objektif and subjektif), secara percuma untuk OS Android. | ||
 |
 |
|
6.4 Elektrolisis Dalam Industri
Kegunaan elektrolisis dalam industri
■ Kegunaan elektrolisis dalam industri
Pengekstrakan logam
■ Pengekstrakan logam
■ Pengekstrakan logam aluminium
■ Video berikut menunjukkan proses pengekstrakan bauksit.
Penulenan logam
■ Penulenan logam
■ Penulenan kuprum
■ Video berikut menunjukkan penulenan kuprum dalam siri animasi.
Penyaduran logam
■ Penyaduran logam
■ Penyaduran sudu logam dengan argentum
■ Video berikut menunjukkan elektrik duit syiling dengan nikel dan kuprum.
■ Kegunaan elektrolisis dalam industri
| ► | Pengekstrakan logam | |
| ► | Penulenan logam | |
| ► | Penyaduran logam |
■ Pengekstrakan logam
| ► | Elektrolisis boleh digunakan untuk mengekstrak logam daripada bijihnya. | |
| ► | Digunakan untuk mengekstrak logam yang lebih reaktif daripada karbon - kalium, natrium, kalsium, magnesium dan aluminium. |
| ► | Diekstrakkan daripada bijih bauksit yang mengandungi aluminium oksida(Al2O3) | |||||||||||||
| ► | Leburan aluminium oksida bercampur dengan crylolite untuk menurunkan takat lebur. | |||||||||||||
| ► | Elektrolisis dengan menggunakan elektrod karbon. |
|||||||||||||
| ► |
|
■ Penulenan logam
| ► | Elektrolisis boleh digunakan untuk menulenkan logam yang tidak tulen. | |
| ► | Katod: Logam tulen ; anod: Logam tidak tulen | |
| ► | Elektrolit: garam yang mengandungi ion logam yang hendak ditulenkan |
| ► |  |
|||||||||||||
| ► |
|
|||||||||||||
| ► | Bendasing yang terbentuk terkumpul di dasar bekas. |
■ Penyaduran logam
| ► | Elektrolisis boleh digunakan untuk meletakkan lapisan logam pada objek. | |
| ► | Katod: Objek yang hendak bersadur ; Anod: Logam yang digunakan untuk menyadurkan objek. | |
| ► | Elektrolit: Garam yang mengandungi ion logam bagi anod. |
| ► |  |
|||||||||||||
| ► |
|
| ⇲ Dapatkan latihan (objektif and subjektif), secara percuma untuk OS Android. | ||
 |
 |
|
Aktiviti Makmal 6.3.3: Jenis-jenis elektrod
 |
Aktiviti Makmal 6.3.3: Jenis-jenis elektrod |
Pernyataan masalah: Bagaimanakah jenis elektrod mempengaruhi pemilihan ion untuk dinyahcas?
Hypothesis: Jenis elektrod akan mempengaruhi pilihan ion yang akan dinyahcas.
Pembolehubah:
| » | Pembolehubah dimalarkan: Jenis elektrolit dan kepekatan ion | |
| » | Pembolehubah dimanipulasikan: Jenis elektrod | |
| » | Pembolehubah bergerakbalas: Jenis-jenis ion dinyahcas di anod dan katod |
|
Bahan: » Larutan kuprum (II) sulfat » Air suling |
Radas: »Sel elektrolitik »Tabung uji »Elektrod karbon »Suis »Wayar penyambung »Klip buaya »Kayu uji »Bateri |
| ► | Animasi berikut menunjukkan prosedur dan pemerhatian eksperimen.
|
|||||||||||||
| ► |
|
| ► | Electrolisis larutan kuprum(II) sulfat dengan menggunakan karbon elektrod
|
|||||||||||||
| ► | Electrolisis larutan kuprum(II) sulfat dengan menggunakan kuprum elektrod
|
| ► | Electrolisis larutan kuprum(II) sulfat dengan menggunakan karbon elektrod
|
|||||||||||||
| ► | Electrolisis larutan kuprum(II) sulfat dengan menggunakan kuprum elektrod
|
| ► | Elektrod yang berbeza digunakan dalam elektrolisis menghasilkan hasil yang berbeza di anod dan di katod. | |
| ► | Hipotesis diterima. |
| ⇲ Dapatkan latihan (objektif and subjektif), secara percuma untuk OS Android. | ||
 |
 |
|
Aktiviti Makmal 6.3.2: Kepekatan ion dalam larutan elektrolit
 |
Aktiviti Makmal 6.3.2: Kepekatan ion dalam larutan elektrolit |
Pernyataan masalah: Bagaimanakah kepekatan ion mempengaruhi pemilihan ion untuk dinyahcas?
Hipotesis: Ion yang lebih pekat akan dinyahcas terlebih dahulu pada elektrod.
Pembolehubah:
| » | Pembolehubah dimalarkan: Elektrolit dan jenis elektrod | |
| » | Pembolehubah dimanipulasikan: Kepekatan ion | |
| » | Pembolehubah bergerakbalas: Jenis-jenis ion dinyahcas di anod dan katod |
|
Bahan: » » Larutan kalium bromida 2 mol dm-3 dan 0.001 mol dm-3 |
Radas: »Sel elektrolitik »Tabung uji »Elektrod karbon »Suis »Wayar penyambung »Klip buaya »Kayu uji »Bateri |
| ► | Animasi berikut menunjukkan prosedur dan pemerhatian eksperimen.
|
|||||||
| ► |
|
| ► | Larutan kalium bromida 2 mol dm-3
|
||||||||||
| ► | Dilute potassium bromide solution 0.001 mole dm-3
|
| ► | Larutan kalium bromida 2 mol dm-3
|
|||||||||||||
| ► | Larutan cair kalium bromida 0.001 mole dm-3
|
| ► | Semakin tinggi kepekatan ion dalam larutan akueus, lebih mudah ia dinyahcaskan semasa elektrolisis. | |
| ► | Hipotesis diterima. |
| ⇲ Dapatkan latihan (objektif and subjektif), secara percuma untuk OS Android. | ||
 |
 |
|
Aktiviti Makmal 6.3.1 : Kedudukan ion dalam siri elektrokimia
 |
Aktiviti Makmal 6.3.1 : Kedudukan ion dalam siri elektrokimia |
Pernyataan masalah: Bagaimanakah kedudukan ion dalam siri elektrokimia mempengaruhi pemilihan ion untuk dinyahcas?
Hypothesis: Ion yang terletak di kedudukan yang lebih rendah dalam siri elektrokimia akan dinyahcas dengan lebih mudah pada elektrod.
Variable:
| » | Pembolehubah dimalarkan: Kepekatan elektrolit dan jenis elektrod | |
| » | Pembolehubah dimanipulasikan: Kedudukan ion dalam siri elektrokimia | |
| » | Pembolehubah bergerakbalas: Jenis-jenis ion dinyahcas di anod dan katod |
|
Bahan: » Asid sulfurik cair » Kuprum (II) sulfat |
Radas: »Sel elektrolitik »Tabung uji »Elektrod karbon »Suis »Wayar penyambung »Klip buaya »Kayu uji »Bateri |
| ► | Animasi berikut menunjukkan prosedur dan pemerhatian eksperimen.
|
|||||||
| ► |
|
| ► | Asid sulfurik cair
|
|||||||||||||
| ► | Copper(II) sulphate solution
|
| ► | Asid sulfurik cair
|
|||||||||||||
| ► | Copper(II) sulphate solution
|
| ► | Kedudukan ion dalam siri elektrokimia mempengaruhi ion yang dipilih untuk dinyahcas pada elektrod. Oleh itu, elektrolisis
|
|||||
| ► | Hipotesis diterima. |
| ⇲ Dapatkan latihan (objektif and subjektif), secara percuma untuk OS Android. | ||
 |
 |
|
Subscribe to:
Posts (Atom)


